8.5 Simultánní chemické reakce
V případě simultánních chemických reakcí předpokládáme,
že v systému probíhají minimálně dvě chemické reakce.
Paralelní či bočné chemické reakce. V případě dvou chemických reakcí I. řádu předpokládáme reakční schéma
![]()
Pro rychlosti úbytku látky A a přírůstky produktů R a S platí rovnice
![]()
Pro koncentrace látek v čase τ platí
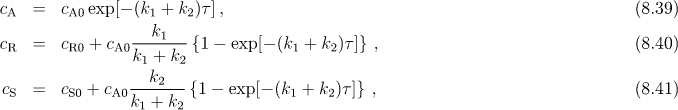
kde cA0, cR0, cS0 jsou počáteční koncentrace látek A, R a S.
V případě dvou chemických reakcí II. řádu předpokládáme reakční schéma
![]()
Pro rychlosti úbytků látek A a B a přírůstků produktů platí
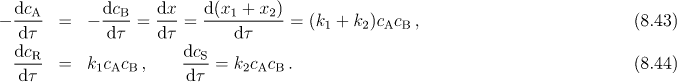
Koncentrace látek v čase τ je možno vyjádřit relacemi
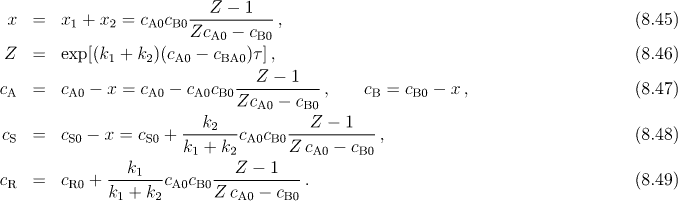
U mechanismů (8.37) a (8.42) platí tzv. Wegscheiderův princip
![]()
který se
uplatňuje pokud probíhající reakce jsou stejného řádu.
Protisměrné či vratné chemické reakce. V tomto případě budeme v systému uvažovat následující reakce:
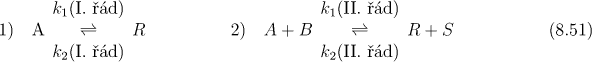
Pokud uvažujeme první variantu v (8.51) platí následující rychlostní rovnice
![]()
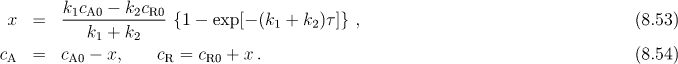
kde cA0 a cR0 jsou počáteční koncentrace látek A a R.
V rovnováze platí dx/dτ = 0 a pro rovnovážnou hodnotu x = xr dostaneme
![]()
![]()
je rovnovážná konstanta první reakce (8.51). V rovnovážném stavu, tj. v čase τ → ∞ jsou koncentrace látek A a R dány výrazy
![]()
U druhé rovnice (8.51) dostáváme obecně integrovatelné, avšak relativně komplikované vztahy (až na některé zvláštní výjimky – jednou z nich je případ řešený v příkladu 8.5.11), které dále nebudeme aplikovat. Rovnovážný stav je jednodušší určit postupy, které byly probírány v kapitole o chemické rovnováze.
Následné reakce. Dále budeme uvažovat v systému následující reakční schéma
![]()
Rychlosti úbytku či přírustku reagujících látek jsou dány rovnicemi
![]()
Pro koncentrace látek A, B a C dostaneme následující relace (platí pro cB0 = cC0 = 0)
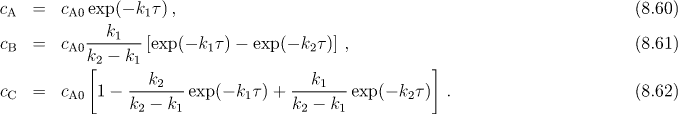
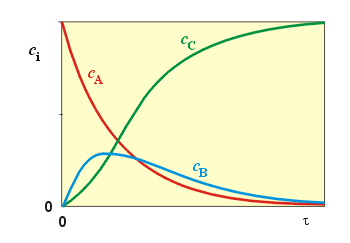
Průběh cA, cB a cC v závislosti na čase je na uvedeném obrázku.
Pro extrém u koncentrace meziproduktu B platí
![]()
Příklady:
8.5.1 Paralelní reakce I. řádu (8.5.2 Paralelní reakce, výpočet teploty a koncentrace (
8.5.3 Paralelní reakce, výpočet složení a vliv teploty (
8.5.4 Paralelní reakce, výpočet rychlostní konstanty a složení (
8.5.5 Paralelní reakce II. řádu (
8.5.6 * Paralelní reakce I. a II. řádu (
8.5.7 Vratné reakce, racemizace (
8.5.8 * Vratné reakce, izomerizace (
8.5.9 Vliv teploty na reakční rychlost u vratných reakcí (
8.5.10 Vratná reakce v plynné fázi, výpočet složení (
8.5.11 * Vratná reakce II. řádu, zvláštní případ (
8.5.12 Následné reakce, výpočet koncentrací (
8.5.13 Následné reakce, doba na dosažení maximální koncentrace meziproduktu (
8.5.14 Maximální koncentrace radonu (
8.5.15 * Následné reakce, hydrolýza yperitu (
8.5.16 Čtyři následné reakce se stejnou konstantou (
8.5.17 * Následné reakce, varianty výpočtu koncentrací (
8.5.18 Následné reakce, varianty výpočtu maximální koncentrace meziproduktu (
8.5.19 Kombinace následné a vratné reakce (