10.3.1 Výpočet složení kapaliny a páry
Při teplotě 30 °C má pentan(1) tlak nasycených
par ![]() = 81,8 kPa a isopentan(2)
= 81,8 kPa a isopentan(2) ![]() =
109,1 kPa. Za předpokladu platnosti Raoultova zákona
vypočítejte složení směsi těchto látek (hodnotu x1), která má
normální teplotu varu 30 °C, a odpovídající složení parní fáze.
Rozhodněte dále, v jaké fázi se nachází směs, která obsahuje 40
mol.% pentanu při teplotě t = 30 °C a tlaku a) p = 95 kPa a
b) 97 kPa. Pokud se směs bude nacházet ve dvoufázové oblasti,
určete relativní množství jednotlivých fází.
=
109,1 kPa. Za předpokladu platnosti Raoultova zákona
vypočítejte složení směsi těchto látek (hodnotu x1), která má
normální teplotu varu 30 °C, a odpovídající složení parní fáze.
Rozhodněte dále, v jaké fázi se nachází směs, která obsahuje 40
mol.% pentanu při teplotě t = 30 °C a tlaku a) p = 95 kPa a
b) 97 kPa. Pokud se směs bude nacházet ve dvoufázové oblasti,
určete relativní množství jednotlivých fází.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
x1 = 0,2855, y1 = 0,2299
Při 95 kPa bude směs plynná, při 97 kPa dvoufázová s poměrem obou fází
![]()
Řešení
Za předpokladu platnosti Raoultova zákona
![]()
bude při normálním bodu varu platit
![]()
Molární zlomek první složky x1 v kapalné fázi je dán relací

Složení parní fáze udává molární zlomek složky 1 v parní fázi

Směs se bude nacházet v kapalné fázi, pokud platí p > pv, kde pv je tlak směsi o složení kapalné fáze x1 = 0,4. Naproti tomu se směs bude nacházet v plynné fázi, platí-li p < pR, kde pR je rosný tlak, který odpovídá složení parní fáze y1 = 0,4. Platí-li pR < p < pv, budou v systému obě fáze. Tlak pv je určen vztahem (10.21)
![]()
Pro rosný tlak pR platí vztah (10.24)
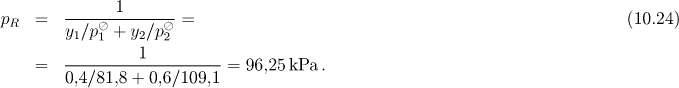
Za tlaku p = 95 kPa se tedy bude směs nacházet v homogenní plynné oblasti. Za tlaku p = 97 kPa dostaneme z rovnic (10.21) a (10.23)
![]()
Poměr látkových množství kapalné n(l) a parní n(g) fáze bude podle pákového pravidla roven

V této rovnici N1 představuje celkový molární zlomek složky 1 v systému, tj. v kapalné i parní fázi jako celku.
![[Maple Plot]](images/fazVI6.gif)