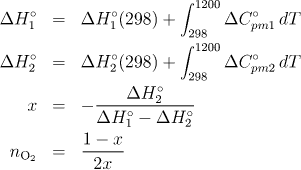3.6.6 Kombinace exotermní a endotermní reakce
Oxid uhelnatý se vyrábí přeháněním směsi CO2 a O2 přes
rožhavený
uhlík za normálního tlaku. Probíhají současně tyto reakce:
C(s) + CO2(g) = 2 CO(g) ΔH°r(298,15 K)=172,45 kJ/mol,
C(s) + (1/2) O2 =CO(g) ΔH°r(298,15 K)=−110,53 kJ/mol,
přičemž reaktanty v plynném stavu mají teplotu 1200 K. Určete
poměr látkového množství O2 a CO2, aby úhrnné reakční teplo
bylo nulové. Konstanty pro teplotní závislost molárních tepelných
kapacit nalezněte v tabulkách.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
[ I.: ΔC°pm = 3,939−6,009 . 10−3T J mol−1 K−1, ΔH°I(1200 K) = 171,94 kJ/ mol,
II.:ΔC°pm = −4,007−3,677 . 10−3T J mol−1 K−1, ΔHII°(1200 K) = −111,66 kJ/ mol ] ,
na 1 mol CO2 připadne 0,77 mol O2.
Postup
Symbolem x je označen podíl prvé reakce. Látkové množství kyslíku je ve srovnání s podílem druhé reakce poloviční. Proto použijte vztahy