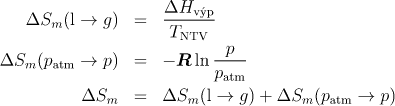4.1.23 Metastabilní vypaření
Vypočtěte změnu entropie a entalpie pro případ, kdy přehřátá voda
o teplotě 100 °C a tlaku p=90 kPa přejde na páru o stejné teplotě
a tlaku.
Předpokládejte, že objem kapalné vody nezávisí na teplotě a
tlaku a že pro parní fázi platí stavová rovnice ideálního plynu. Potřebné
údaje nalezněte v tabulkách.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔHm = 40,65 kJ mol−1 ΔSm =109,92 J K−1mol−1
Postup
Úhrnný děj
H2O(l, t = 100 °C, p = 90 kPa) ⟶ H2O(g, t = 100 °C, p = 90 kPa)
rozdělíme na dva dílčí děje: vypaření vody a změnu tlaku vodní
páry.
Entalpie a entropie kapalné fáze podle uvažované aproximace
nezávisí na tlaku a na tlaku nezávisí ani entalpie plynné fáze.
Pro změnu entalpie platí vztah
![]()
Pro výpočet entropie použijte vztahy (4.8) a (4.10) (teplota normálního bodu varu je označena TNTV):