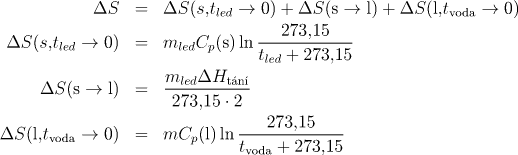4.1.26 Změna entropie ve směsi ledu a vody
K 60 g ledu o teplotě −8 °C bylo přidáno takové množství vody o teplotě
25 °C, aby při 0 °C polovina ledu roztála. Vypočtěte hmotnost
přidané vody a změnu entropie při tomto ději. Teplo vyměněné s okolím
je nulové.
Data: ![]()
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
m=106,08 g
ΔS(s,−8 → 0) = 3,69 J K−1 ΔS(s → l) = 36,95 J K−1
ΔS(l,25 → 0) = −38,83 J K−1 ΔS = 1,81 J K−1
Postup
Popsaný děj rozdělíme do tří kroků:
1) ochlazení vody z 25 °C na 0 °C
(ΔH1, ΔS1)
2) ohřev ledu z -8 °C na 0 °C
(ΔH2, ΔS2)
3) roztání poloviny ledu (ΔH3, ΔS3)
Protože je teplo vyměněné s okolím nulové, platí bilance entalpie
![]()
a tedy
![]()
Z této rovnice vypočítáme potřebné množství vody mvoda. Pro změnu entropie platí vztahy