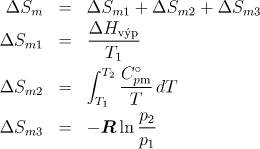4.1.25 Změna entropie při přechodu z kapalného do plynného stavu za stálého tlaku
Jeden mol NH3 je převeden z kapalného stavu (T1 = TNTV=240 K, p1=101 kPa) do plynného o parametrech T2=473 K a p2=202 kPa. Určete příslušnou změnu molární entropie. Páry NH3 se chovají ideálně. Odpovídající údaje nalezněte v tabulkách. Molární tepelnou kapacitu považujte za závislou na teplotě
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓