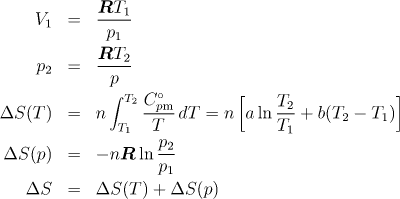4.1.9 Změna entropie s teplotou a tlakem
Vypočtěte změnu entropie, která doprovází zahřátí 1 mol H2S(g) z teploty 50 °C na teplotu 100 °C za konstantního objemu (počáteční tlak je p1=101,32 kPa) a následující izotermní expanzi do stavu, kterému odpovídá tlak p3=101,32 kPa. U sirovodíku předpokládejte, že se chová jako ideální plyn. Molární tepelná kapacita sirovodíku závisí na teplotě; konstanty rovnice pro C°pm nalezněte v tabulkách.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
[V = 26,52 dm3 p2 = 117 kPa
ΔS(T) = 5,504 J K−1 ΔS(p) = 1,196 J K−1 ]
ΔS = 5,007 J K−1
Postup
Entropie je stavová funkce a její změna nezávisí na cestě. Proto je možné děj rozdělit na dvě části: změnu entropie s teplotou a změnu entropie s tlakem. Použijte tyto vztahy (viz příklad 4.1.8):