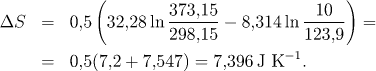4.1.8 Závislost entropie ideálního plynu na teplotě a tlaku
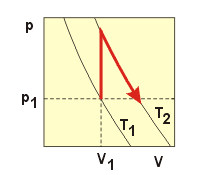 Jedna polovina molu plynného kyslíku expanduje z počátečního
stavu V1 = 10 dm3 a t1 = 25 °C do
konečného stavu, daného
Jedna polovina molu plynného kyslíku expanduje z počátečního
stavu V1 = 10 dm3 a t1 = 25 °C do
konečného stavu, daného
a) teplotou t2 = 100 °C a objemem V2 = 50 dm3
b) teplotou t2 = 100 °C a tlakem p2 = 50 kPa.
Vypočítejte změny entropie, příslušející těmto dějům.
Předpokládejte, že stavové chování kyslíku se řídí
stavovou rovnicí ideálního plynu.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔS1 = 9,380 J K−1 p1 = 123,9 kPa ΔS2 = 7,396 J K−1
Řešení
a) Pro změnu entropie s teplotou a objemem platí vztah (4.7)
![]()
který pro ideální plyn a konstantní hodnotu molární kapacity má tvar (4.9)
![]()
V tabulkách nalezneme pro molární tepelnou kapacitu kyslíku hodnotu 32,28 J K−1mol−1. Protože se kyslík chová jako ideální plyn, pro rozdíl molárních tepelných kapacit platí Mayerův vztah
![]()
Po dosazení dostaneme
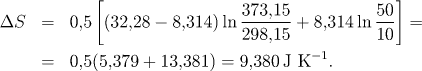
b) Pro změnu entropie s teplotou a tlakem platí vztah (4.6)
![]()
který pro případ ideálního plynu a konstantní molární tepelné kapacity přejde na tvar (4.8)
![]()
Počáteční tlak vypočítáme ze stavové rovnice ideálního plynu:
![]()
Po dosazení dostaneme výsledek