4.4.1 Výpočet ΔU, ΔH a ΔS pomocí van der Waalsovy rovnice
Vypočítejte změnu vnitřní energie, entalpie a entropie, která doprovází převedení jednoho molu ethanu ze stavu o objemu V1 = 22,414 dm3 do stavu o objemu V2 = 200 cm3 za stálé teploty 273,15 K. Při výpočtu předpokládejte platnost van der Waalsovy rovnice. Pro srovnání určete tyto změny i na základě stavové rovnice ideálního plynu.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔU = −2764,93 J ΔH = −4439,78 J ΔS = −42,47 J K−1
Ideální plyn:
ΔU = 0 ΔH = 0 ΔS = −39,23 J K−1
Řešení
V tabulkách nalezneme konstanty van der Waalsovy rovnice
![]()
Pro změnu vnitřní energie systému v závislosti na teplotě a objemu platí vztah (4.21)
![]()
Při aplikaci tohoto vztahu na van der Waalsovu rovnici získáme
![]()
Pro změnu vnitřní energie tedy dostaneme
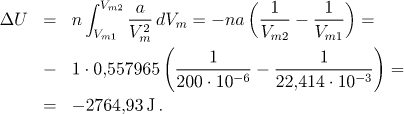
Změnu entalpie je dána definiční rovnicí:
![]()
Počáteční a konečný tlak určíme z van der Waalsovy rovnice:
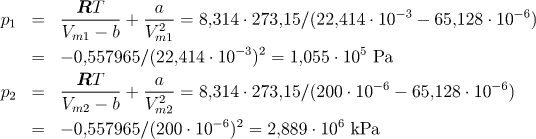
Po dosazení dostaneme
![]()
Stanovení změny entropie s objemem v případě reálného plynu, jehož stavové chování odpovídá van der Waalsově rovnici, lze provést podobným postupem jako u vnitřní energie. S použitím vztahu (4.7) dostaneme
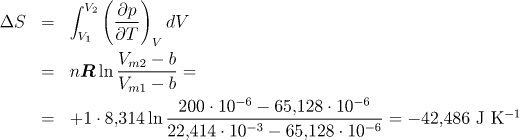
Pokud bychom výpočet entropie provedli pro ideální plyn (a = b = 0), dostali bychom tyto hodnotu ΔS = -39,23 J K−1.