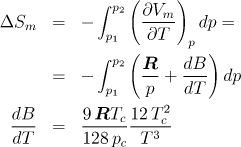4.4.3 Výpočet změny entropie s tlakem pro různé modely stavového chování plynu
Vypočtěte změnu molární entropie u butanu, spojenou se zvýšením
tlaku ze 100 na 200 kPa při teplotě 25 °C. Výpočet proveďte
a) Pro ideální plyn.
b) Předpokládejte, že
stavové chování butanu popisuje stavová rovnice
Vm = RT/p+B, kde ![]()
Kritické veličiny butanu nalezněte v tabulkách.
c) Za předpokladu platnosti van der Waalsovy stavové rovnice. Pro
tento případ použijte k výpočtu systému MAPLE a konstanty rovnice
nalezněte v tabulkách.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓