4.4.7 Cv,Cp a Jouleova-Thomsonova koeficientu pro reálný plyn
Vypočítejte hodnoty Cvm, Cpm a μJT ethanu při teplotě T = 310 K a při molárním objemu Vm = 250 cm3/mol a zjistěte jakému tlaku vypočítané hodnoty odpovídají. Předpokládejte, že ethan se řídí van der Waalsovou rovnicí.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
Cvm = 51,75 J mol−1 K−1
[![]() Pa/K
Pa/K ![]() Pa m−3]
Pa m−3]
Cpm = 208,86 J mol−1 K−1 μJT = 1,553 . 10−5 K Pa−1
p = 5,01 . 106 Pa
Řešení
V tabulkách nalezneme hodnoty pro konstanty van der Waalsovy rovnice:
a = 0,557965 Pa m6mol−2
b = 6,5128.10−5 m3mol−1
a konstanty rozvoje pro molární tepelnou kapacitu (J mol−1K−1):
![]()
Pro výpočet molární tepelné kapacity při konstantním objemu Cvm použijeme vztah (4.24). K dispozici máme hodnotu C°vm, která odpovídá ideálnímu plynu. Jako dolní mez integrace použijeme Vm1 → ∞, což je objem odpovídající nulovému tlaku. Plyn se v tomto stavu chová ideálně. Platí tedy
![]()
V případě aplikace van der Waalsovy rovnice platí
![]()
a proto
![]()
Tepelnou kapacitu za konstantního tlaku určíme z relace
![]()
U ideálního plynu přejde tato rovnice na jednoduchý Mayerův vztah
![]()
Hodnoty derivací vypočítáme ze vztahů
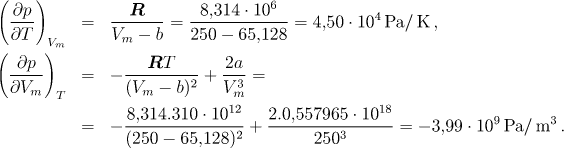
a po dosazení dostaneme výsledek
![]()
K výpočtu Jouleova-Thomsonova koeficientu použijeme vztah (4.25):
![]()
z nějž po dosazení získáme hodnotu
![]()
Dané teplotě a objemu odpovídá tlak
![]()