5.5.1 * Výpočet chemického potenciálu, aktivity a aktivitního koeficientu ze závislosti dodatkové Gibbsovy energie na složení
U systému benzen(1)+cyklohexan(2) byla na základě dat o rovnováze mezi kapalnou
a parní fází při 70 °C zjištěno, že je možné aplikovat vztah pro regulární roztok
GE = x1x2B s B = 1000 J/mol (viz (5.60).
Za předpokladu, že při této teplotě jsou molární Gibbsovy energie
čistých látek v kapalném stavu rovny hodnotám Gm,1• = 117550 J mol−1, Gm,2• = 18284 J mol−1 (slučovací Gibbsovy energie),
potom u směsi obsahující 40 mol.% benzenu vypočtěte: a) molární
Gibbsovu energii směsi, b) chemické potenciály složek,
c) aktivitní koeficienty a aktivity složek. d) Řešte úlohy v bodech
a) až c) také pro případ Gm,1• = Gm,2• = 0.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a) Gm = 56310,33 J mol−1,
b) μ1 = 115296 J mol−1, μ2 = 16986 J mol−1 ,
c) γ1 = 1,134, γ2 = 1,0577, a1 = 0,4538, a2 = 0,6346,
d) Gm = −1680 J mol−1, μ1 = −2254 J mol−1, μ2 = −1297 J mol−1, aktivitní koeficienty a aktivity
zůstávají stejné.
Řešení
a) Molární Gibbsova energie je dána vztahem (5.13)
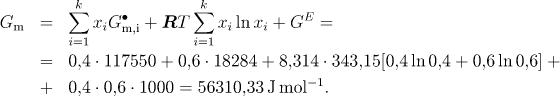
b) Pro chemický potenciál i−té složky u binárního systému plyne ze vztahu (5.58) a (5.61) relace
![]()
z níž po dosazení dostaneme
![]()
c) Aktivitní koeficient a aktivita jsou určeny relacemi (5.61), (5.62) a (5.65). Po dosazení konkrétních hodnot získáme
![]()
![]()
d) Po dosazení nulových hodnot molární Gibbsovy energie čistých látek do dříve použitých vztahů dostaneme
![]()
Hodnoty aktivitních koeficientů a aktivit zůstávají stejné.