6.2.8 Hydrolýza a pH roztoků solí slabých kyselin a slabých zásad
Určete, z kolika procent je při teplotě 25°C
hydrolyzována sůl slabé kyseliny a slabé zásady typu BA
v roztoku o koncentraci cpoč = 0,1 mol/dm3 pro případ:
KHA = 10−3, KBOH = 10−6 . Vypočtěte rovněž pH takového roztoku.
Iontový součin vody Kv má při této teplotě hodnotu
1,0.10−14. Standardní stav c° = 1 mol/dm3.
Předpokládejte jednak ideální chování (![]() ) a
jednak platnost limitního Debyova-Hückelova vztahu
(A = 1,1762( dm3/ mol)1/2).
) a
jednak platnost limitního Debyova-Hückelova vztahu
(A = 1,1762( dm3/ mol)1/2).
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
0,63 molárních procent, pH = 5,50
Řešení
Sůl slabé kyseliny a slabé zásady BA je v roztoku obsažena (převážně) ve formě svých iontů B+ a A−, které dále reagují s vodou podle reakcí
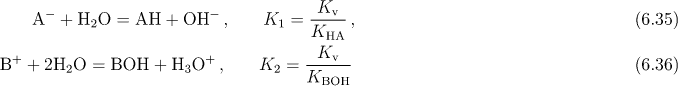
Vedle iontů H3O+ a OH− vzniklých touto hydrolýzou, jsou v roztoku ještě přítomny ionty H3O+ a OH− vzniklé disociací vody, tj.
![]()
Označíme-li zreagovaná látková množství v objemové jednotce u uvedených tří reakcí symboly x1, x2 a x3, dostaneme pro konstanty K1, K2, K3 tyto výrazy
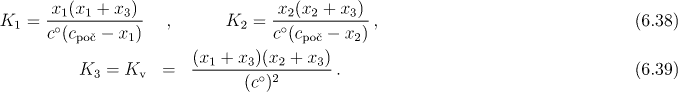
Tato soustava tří rovnic pro tři neznámé se dá převést na následující dvě rovnice
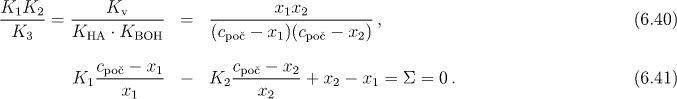
Při řešení této soustavy rovnic je možno při výpočtu na kalkulačce použít
následující iterační postup:
a) zvolíme x1,
b) vypočteme pomocnou proměnnou Z
![]()
![]()
d) dosazením do (6.41) ověříme jak dalece je pravá strana (Σ) různá od nuly. Při nedostatečné shodě volíme jiné x1 a vrátíme se k bodu a).
Příklad výpočtu pH pro případ, kdy
cpoč = 0,1 mol/ dm3, KHA = 1 . 10−3, K BOH = 1 . 10−6, Kv = 1 . 10−14, (K1 = 1 . 10−11, K2 = 1 . 10−8).
Zvolíme x1 = 0,001 mol/ dm3. Pomocná proměnná Z bude dána hodnotou
![]()
Pro x2 ze vztahu (6.43) dostaneme
![]()
Dosazením do relace (6.41) získáme
![]()
I když se jedná o relativně malou hodnotu Σ (absolutně)
není možno tento výsledek považovat za dostatečně přesný. Další
vhodnou volbou lze získat následující
hodnoty:
x1 = 3,137 . 10−4 mol/ dm3,
(Z = 3,17776 . 10−3),
x2 = 3,1677 . 10−4 mol/ dm3,
(∑ = −7,4 . 10−8 mol/ dm3).
Z první resp. druhé rovnice (6.39) bychom pro
x1+x3 = cOH− resp. x2+x3 = cH3O+ dostali
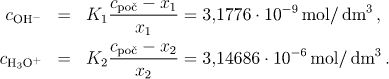
Známe-li koncentraci vodíkových iontů určíme snadno i pH a dostali bychom
pH = −log (3,14686 . 10−6) = 5,502 .
Poznámka
cH3O+ = (x2+x3) = 3,14686 . 10−6
resp.
x3 = cH3O+−x2 = −3,13623 . 10−4 mol/ dm3.
Záporná hodnota x3 znamená, že hydrolýzou se vytvořilo větší množství hydroxoniových a hydroxylových iontů než dovoluje součin rozpustnosti vody a jejich přebytek (x3) musel zreagovat na vodu.
Pokud bychom uvažovali neideální chování, potom dříve uvedená rovnice (6.40) by měla tvar
![]()
Rovnice (6.41) zůstává nezměněna a při výpočtu pH je nutno započítat aktivitní koeficient hydroxoniového iontu.