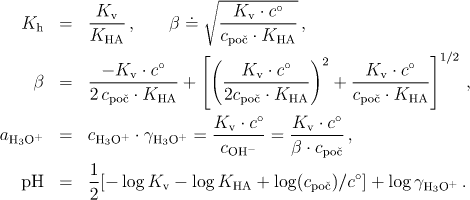6.2.7 Hydrolýza a pH roztoků solí silných kyselin a slabých zásad
Vypočítejte stupeň hydrolýzy a pH
vodných roztoků solí silné kyseliny a slabé zásady o
koncentraci 0,1 a 0,01 mol/dm3, jejichž disociační konstanta
má hodnotu KBOH = 10−3, 10−7, 10−10, 10−14. Výpočet provádějte pro teplotu 25 °C a
jako standardní stav uvažujte ideální roztok o koncentraci c° = 1
mol/dm3 při t = 25 °C. Iontový součin vody má při uvedené
teplotě hodnotu Kv = 1 . 10−14. Předpokládejte jednak
ideální chování všech složek (![]() = 1) a jednak
platnost limitního Debyeova-Hückelova vztahu
(A = 1,1762( dm3/ mol)1/2).
= 1) a jednak
platnost limitního Debyeova-Hückelova vztahu
(A = 1,1762( dm3/ mol)1/2).
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
Viz tabulka v Řešení tohoto příkladu.
Řešení
Soli slabé zásady a silné kyseliny jsou silné elektrolyty – ve vodném roztoku jsou převážně přítomny ve formě iontů. Kationty slabé zásady musí být přitom v rovnováze s nedisociovanými molekulami příslušné zásady; proto reagují s vodou, přičemž uvolňují hydroxoniové ionty
![]()
Ve výrazu pro rovnovážnou konstantu této reakce
![]()
můžeme aktivitu vody považovat za jednotkovou a tuto rovnovážnou konstantu budeme označovat jako hydrolytickou konstantu Kh
![]()
Hydrolytickou konstantu vyjádříme pomocí disociační konstanty slabé zásady a dostaneme
![]()
Protože sůl BA je zcela disociována, je počáteční koncentrace iontů B+ rovna analytické koncentraci soli, cpoč a pro látkovou bilanci reakce (6.26) platí
![]()
kde β značí stupeň
hydrolýzy. Za předpokladu ideálního
chování roztoku (![]() = 1) můžeme nahradit aktivity relativními
koncentracemi a dosadit do rovnice (6.28)
= 1) můžeme nahradit aktivity relativními
koncentracemi a dosadit do rovnice (6.28)
![]()
Při malých hodnotách
stupně hydrolýzy (![]() ) je možno zanedbat β ve
jmenovateli rovnice (6.30). Tak získáme zjednodušený vztah
) je možno zanedbat β ve
jmenovateli rovnice (6.30). Tak získáme zjednodušený vztah
![]()
V některých případech (koncentrovanější roztoky, velmi malá hodnota KBOH - viz tabulku vypočtených hodnot) nelze tuto aproximaci přijmout a pak při výpočtu užíváme stupeň hydrolýzy získaný řešením kvadratické rovnice (6.30)
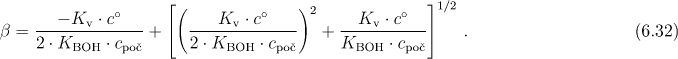
Výpočet pH provedeme podle rovnice
![]()
která vychází ze vztahu (6.29). Pro přibližný výpočet pH lze použít zjednodušenou modifikaci
![]()
Vypočtené hodnoty stupně hydrolýzy a pH jsou pro případ ideálního chování uvažovaných roztoků shrnuty v tab.6.3 (hodnoty β, získané přesným výpočtem podle vztahu (6.32), jsou opět značeny hvězdičkou).
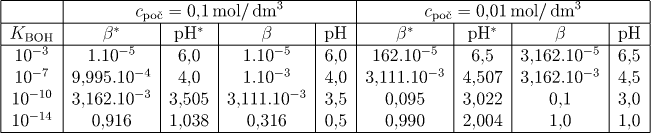
Pokud bychom uvažovali neideální chování vodných roztoků uni-uni valentní soli, dostáváme v případě generalizovaných závislostí pro aktivitní koeficienty stejný stupeň hydrolýzy jako v případě ideálního chování. To vyplývá ze skutečnosti, že ve vztahu (6.28) se vyskytují aktivitní koeficienty γH3O+ a γB+ v poměru. Aktivitní koeficient hydroxoniového iontu se však projeví při výpočtu pH! Jestliže stanovíme hodnotu γH3O+ podle Debyeova-Hückelova vztahu, kdy platí pro uni-uni valentní sůl I = cpoč, pak k hodnotám pH vypočteným podle (6.33) a (6.34) je nutno připočítat v našem případě hodnoty 0,1615 v případě koncentrace soli c = 0,1 a hodnotu 0,0511 v případě roztoku o koncentraci c = 0,01 mol/dm3. To znamená, že v prvním řádku tab.6.3 by v případě reálného chování byly hodnoty pH = 6,1615 a pH = 6,5511.
Z tabelovaných hodnot je patrné, že ve velké většině případů lze použít přibližného výpočtu. Při hodnotách KBOH < 10−10 (viz poslední řádek tabulky) jsou již chyby způsobené touto aproximací příliš velké.
Pro hydrolýzu soli slabé kyseliny a silné zásady lze obdobným postupem odvodit vztahy