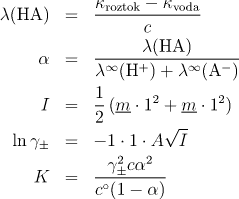7.1.18 Výpočet disociační konstanty
Vodný roztok kyseliny benzoové o koncentraci 0,01 mol dm−3
měl konduktivitu o hodnotě 3,302.10−2 S m−1.
Konduktivita použité vody byla 1,6.10−4 S m−1. Za
předpokladu, že aktivitní koeficient nedisociované kyseliny je
možno pokládat za jednotkový a že pro střední aktivitní koeficient
iontů lze použít Debyeovův-Hückelův limitní vztah
(A=1,1762 mol−1/2kg1/2 pro přirozený
logaritmus), vypočítejte
rovnovážnou konstantu disociace kyseliny benzoové
(pro standardní stav c° = 1 mol dm−3). Limitní
molární vodivosti iontů (S m2mol−1) jsou:
λ∞(H+) =0,03497 λ∞(C6H5COO−) = 0,00323
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓