7.1.17 Výpočet disociační konstanty z vodivostních měření
Při měření konduktivity kyseliny octové při teplotě
25 °C byly získány tyto hodnoty:
| koncentrace c (mol dm−3) | konduktivita (S m−1) | hustota (g cm−3) |
| 0 (čistá voda) | 1,6 . 10−4 | 0,9970 |
| 0,001 | 5,056 . 10−3 | 0,9970 |
| 0,1 | 5,374 . 10−2 | 0,9979 |
Jaká je disociační konstanta kyseliny octové
(a) za
předpokladu, že aktivitní koeficienty jsou rovny jedné,
(b) vypočtená s uvážením aktivitních koeficientů?
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
| αc = 0,1 = 0,013717 | αc = 0,001 = 0,125346 |
| K*c = 0,1 = 1,9077 . 10−5 | K*c = 0,001 = 1,7963 . 10−5 |
|
| Kc = 0,001 = 1,7496 . 10−5 |
Řešení
Kyselina octová disociuje podle rovnice
![]()
Podle látkové bilance disociace platí pro koncentrace
složek vztahy
| látka | začátek | rovnováha |
| CH3COOH (označíme HA) | c | c(1−α) |
| CH3COO− (označíme A−) | 0 | cα |
| H+ | 0 | cα |
![]()
kde c° je standardní koncentrace (1 mol dm−3). Protože koncentrace obou měřených roztoků je poměrně malá, můžeme považovat aktivitní koeficient nedisociované kyseliny octové (elektroneutrální částice) za jednotkový – na rozdíl od nabitých iontů, kde se neideální chování složky v roztoku uplatní už při nízkých koncentracích. Pro Kγ tedy platí
![]()
Stupeň disociace slabých elektrolytů α je podle van't Hoffova zákona (7.7) dán vztahem
![]()
kde λ je molární vodivost roztoku a λ∞ jeho molární vodivost při nekonečném zředění. Po dosazení za obě veličiny má uvedený vztah tvar
![]()
(kyselina octová disociuje na jednomocné ionty v poměru 1:1). Hodnoty limitních molárních vodivostí při nekonečném zředění nalezneme v tabulkách:
![]()
Pro hodnoty stupně disociace potom dostaneme
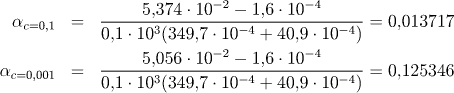
a) Výpočet disociační konstanty za předpokladu,
že aktivitní koeficienty jsou rovny jedné
V tomto případě je Kγ = 1. Po dosazení
do vztahu pro rovnovážnou konstantu dostaneme výsledky
(označíme hvězdičkou)

b) Výpočet s aktivitními koeficienty
Střední aktivitní koeficient disociované kyseliny octové
vypočítáme z Debyeova-Hückelova limitního zákona (7.10)
(při teplotě 25 °C je A =1,1762 kg1/2mol−1/2)
![]()
kde I je iontová síla, která je pro kyselinu octovou dána vztahem (7.11)
![]()
m je molalita. U koncentrace 0,001 mol dm−3 je možné nahradit molality přímo molárními koncentracemi. Pro střední aktivitní koeficient tedy platí
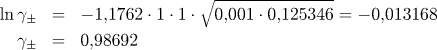
a rovnovážná konstanta disociace má hodnotu
![]()
kde K* je hodnota rovnovážné konstanty disociace, vypočítaná pro předpoklad jednotkových aktivitních koeficientů.
Koncentraci c = 0,1 mol dm−3 přepočítáme na molalitu:
![]()
Symbol M značí molární hmotnost rozpuštěné látky (g mol−1), ϱ hustotu roztoku (g dm−3) a V objem roztoku (dm−3). Střední aktivitní koeficient je dán vztahem
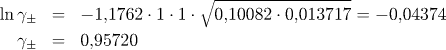
Rovnovážná konstanta disociace má pak hodnotu
![]()
Je zřejmé, že s klesající koncentrací roztoku klesá i jeho neidealita. Zanedbání aktivitních koeficientů způsobí v prvém případě chybu ve výpočtu rovnovážné konstanty 9,1%, ve druhém případě chybu pouze 2,7%.