>
restart;
Nejprve použijeme van der Waalsovu rovnici
>
p:=R*T/(V-b)-a/V^2;
![[Maple Math]](images/staXIII1.gif)
Vypočteme 1. a 2. derivaci podle objemu
>
d1:=diff(p,V);
![[Maple Math]](images/staXIII2.gif)
>
d2:=diff(d1,V);
![[Maple Math]](images/staXIII3.gif)
a určíme podmínky v kritickém bodě
>
r1:=subs(T=Tc,V=Vc,d1=0);
![[Maple Math]](images/staXIII4.gif)
>
r2:=subs(T=Tc,V=Vc,d2=0);
![[Maple Math]](images/staXIII5.gif)
>
r3:=subs(T=Tc,V=Vc,p=pc);
![[Maple Math]](images/staXIII6.gif)
Řešením této soustavy získáme konstanty
a
a
b
a kritický molární objem
>
solve({r1,r2,r3},{a,b,Vc});
![[Maple Math]](images/staXIII7.gif)
>
assign(%);
Vyjádříme kompresibilitní faktor a z jeho asymptotického rozvoje určíme druhý
viriální koeficient
>
z:=p*V/(R*T);
![[Maple Math]](images/staXIII8.gif)
>
asympt(z,V,4);
![[Maple Math]](images/staXIII9.gif)
>
B:=expand(op(2,%)*V);
![[Maple Math]](images/staXIII10.gif)
Nyní dosadíme vstupní data
>
Tc:=305.43;
![[Maple Math]](images/staXIII11.gif)
>
pc:=4.88*10^6;
![[Maple Math]](images/staXIII12.gif)
>
R:=8.314;
![[Maple Math]](images/staXIII13.gif)
>
T:=350;
![[Maple Math]](images/staXIII14.gif)
>
p:=1.*10^6;
![[Maple Math]](images/staXIII15.gif)
>
M:=0.03007;
![[Maple Math]](images/staXIII16.gif)
Vyčíslíme hodnotu druhého virálního koeficientu a z něj určíme molární objem a hustotu.
>
B;
![[Maple Math]](images/staXIII17.gif)
>
Vm:=R*T/p+B;
![[Maple Math]](images/staXIII18.gif)
>
rho:=M/Vm;
![[Maple Math]](images/staXIII19.gif)
Obdobně můžeme postupovat pro Bertheletovu rovnici
>
restart;
>
p:=R*T/(V-b)-a/(T*V^2);
![[Maple Math]](images/staXIII20.gif)
>
d1:=diff(p,V);
![[Maple Math]](images/staXIII21.gif)
>
d2:=diff(d1,V);
![[Maple Math]](images/staXIII22.gif)
>
r1:=subs(T=Tc,V=Vc,d1=0);
![[Maple Math]](images/staXIII23.gif)
>
r2:=subs(T=Tc,V=Vc,d2=0);
![[Maple Math]](images/staXIII24.gif)
>
r3:=subs(T=Tc,V=Vc,p=pc);
![[Maple Math]](images/staXIII25.gif)
>
solve({r1,r2,r3},{a,b,Vc});
![[Maple Math]](images/staXIII26.gif)
>
assign(%);
>
z:=p*V/(R*T);
![[Maple Math]](images/staXIII27.gif)
>
asympt(z,V,4);
![[Maple Math]](images/staXIII28.gif)
>
B:=expand(op(2,%)*V);
![[Maple Math]](images/staXIII29.gif)
>
Tc:=305.43;
![[Maple Math]](images/staXIII30.gif)
>
pc:=4.88*10^6;
![[Maple Math]](images/staXIII31.gif)
>
R:=8.314;
![[Maple Math]](images/staXIII32.gif)
>
T:=350;
![[Maple Math]](images/staXIII33.gif)
>
p:=1.*10^6;
![[Maple Math]](images/staXIII34.gif)
>
M:=0.03007;
![[Maple Math]](images/staXIII35.gif)
>
B;
![[Maple Math]](images/staXIII36.gif)
>
Vm:=R*T/p+B;
![[Maple Math]](images/staXIII37.gif)
>
rho:=M/Vm;
![[Maple Math]](images/staXIII38.gif)
>
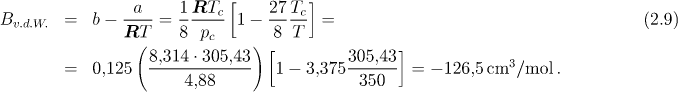
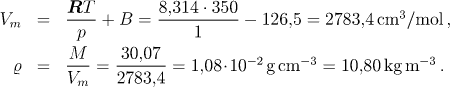
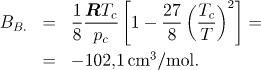
![[Maple Math]](images/staXIII1.gif)
![[Maple Math]](images/staXIII2.gif)
![[Maple Math]](images/staXIII3.gif)
![[Maple Math]](images/staXIII4.gif)
![[Maple Math]](images/staXIII5.gif)
![[Maple Math]](images/staXIII6.gif)
![[Maple Math]](images/staXIII7.gif)
![[Maple Math]](images/staXIII8.gif)
![[Maple Math]](images/staXIII9.gif)
![[Maple Math]](images/staXIII10.gif)
![[Maple Math]](images/staXIII20.gif)
![[Maple Math]](images/staXIII21.gif)
![[Maple Math]](images/staXIII22.gif)
![[Maple Math]](images/staXIII23.gif)
![[Maple Math]](images/staXIII24.gif)
![[Maple Math]](images/staXIII25.gif)
![[Maple Math]](images/staXIII26.gif)
![[Maple Math]](images/staXIII27.gif)
![[Maple Math]](images/staXIII28.gif)
![[Maple Math]](images/staXIII29.gif)