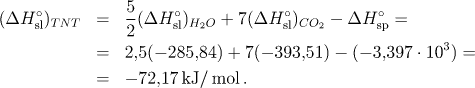3.4.1 Stanovení slučovací entalpie z kalorimetricky zjištěných dat
 Při experimentu, jehož cílem bylo určení slučovací entalpie
trinitrotoluenu (TNT), bylo zjištěno, že během totálního
spálení 0,1 g TNT (mTNT) v kalorimetrické bombě přešlo
při 25 °C do okolí teplo Q = 1500 J. Pomocí slučovacích
tepel CO2(g) a H2O(l) určete slučovací teplo TNT.
Molární hmotnost TNT je 227 g/mol; slučovací tepla při 25 °C
nalezněte v tabulkách.
Při experimentu, jehož cílem bylo určení slučovací entalpie
trinitrotoluenu (TNT), bylo zjištěno, že během totálního
spálení 0,1 g TNT (mTNT) v kalorimetrické bombě přešlo
při 25 °C do okolí teplo Q = 1500 J. Pomocí slučovacích
tepel CO2(g) a H2O(l) určete slučovací teplo TNT.
Molární hmotnost TNT je 227 g/mol; slučovací tepla při 25 °C
nalezněte v tabulkách.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔH°sp = −3,397 . 103 kJ/ mol (Δ H°sl)TNT = − 72,17 kJ/ mol
Řešení
V kalorimetru při spalování TNT probíhá reakce
C7H5N3O6(s) + ![]() O2(g) =
7 CO2(g)
+
O2(g) =
7 CO2(g)
+ ![]() N2(g) +
N2(g) +![]() H2O(l) ,
H2O(l) ,
pro níž (děj při konstantním objemu) platí
![]()
Změna entalpie pro tuto reakci bude podle definiční rovnice entalpie dána (uvažujeme-li, že látky v plynném stavu se chovají podle stavové rovnice ideálního plynu a objemy látek v kapalném a tuhém stavu zanedbáváme) vztahem
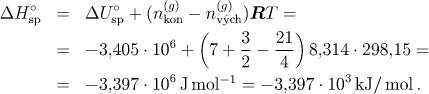
Podle Hessova zákona (3.20) platí
![]()
a odtud vyplývá