3.4 Hessův zákon
Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Mezi oběma veličinami platí vztah
![]()
kde ngkon je látkové množství plynných látek, vzniklých při reakci. Pro jeden mol reakčního obratu tedy platí
![]()
Symbolem νgkon je označen stechiometrický koeficient produktu. Obdobná rovnice platí i pro výchozí látky. Reakční entalpii reakce lze vypočítat ze slučovacích nebo spalných tepel jednotlivých látek podle rovnic
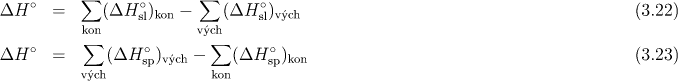
Příklady:
3.4.1 Stanovení slučovací entalpie z kalorimetricky zjištěných dat (3.4.2 Výpočet reakční entalpie na základě slučovacích entalpií látek (
3.4.3 Výpočet reakční entalpie podle Hessova zákona (
3.4.4 Hessův zákon I (
3.4.5 Hessův zákon II (
3.4.6 Standardní slučovací a spalné entalpie (
3.4.7 Spalné teplo a výhřevnost (
3.4.8 Výpočet standardní slučovací entalpie pomocí Hessova zákona (
3.4.9 Výpočet změny entalpie a vnitřní energie při chemické reakci v plynném a kapalném stavu (
3.4.10 Spalování směsi plynů (
3.4.11 Výpočet počátečního složení z bilance entalpie (