3.4.3 Výpočet reakční entalpie podle Hessova zákona
Na základě reakčních entalpií následujících reakcí (všechny
látky, s výjimkou uhlíku, jsou uvažovány v plynném stavu při
25 °C)
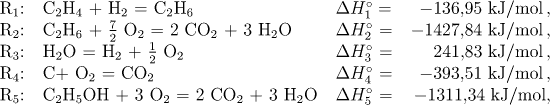
vypočítejte reakční entalpii pro reakci
R6: C2H4 + H2O = C2H5OH ΔH°6 = ?
a slučovací teplo plynného ethanolu.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
(ΔH°sl)C2H5OH = −201,17 kJ (Δ H°sl)C2H6 = − 84,67 kJ/ mol
(ΔH°sl)C2H4 = −11,62 kJ ΔH°6 = − 11,62 kJ/ mol
Řešení
Postupovat můžeme dvojím způsobem. V prvním vypočítáme slučovací entalpie všech látek a z nich hledané reakční teplo podle Hessova zákona. V druhém případě kombinujeme reakce tak, abychom získali požadovanou reakci.
Použijeme nejdříve prvního postupu. Podle definice slučovací entalpie je zřejmé, že platí
![]()
a
![]()
Známe-li slučovací entalpie CO2 a H2O, můžeme vypočítat slučovací entalpii ethanolu na základě ΔH°5. Podle rovnice (3.22) platí
![]()
a tedy
![]()
Abychom vypočítali ΔH°6, potřebujeme znát slučovací entalpii C2H4, kterou určíme z první rovnice. Dříve však musíme vypočítat na základě druhé rovnice slučovací entalpii C2H6. Podle Hessova zákona (3.22) platí vztahy
![]()
Na základě tohoto výsledku stanovíme
![]()
Nyní můžeme vypočítat reakční entalpii u šesté reakce:
![]()
Při druhém způsobu řešení vyjdeme z toho, že platí
R6 = 1 R1 + 1 R2 + 1 R3 - 1 R5
tj.
1(C2H4 + H2) + 1(C2H6 + ![]() O2) +
1(H2O) - 1(C2H5OH + 3 O2) =
O2) +
1(H2O) - 1(C2H5OH + 3 O2) =
= 1(C2H6) + 1(2 CO2 + 3 H2O) + 1(H2 +
![]() O2) - 1(2 CO2 + 3 H2O) .
O2) - 1(2 CO2 + 3 H2O) .
Podle Hessova zákona je tedy
![]()
Podobně pro slučovací entalpii C2H5OH, tj. pro reakci
2 C + 3 H2 + ![]() O2 = C2H5OH
O2 = C2H5OH
platí
![]()