5.4 Chemický potenciál látky v plynném stavu, její fugacita, fugacitní koeficient a aktivita
Pro chemický potenciál i−té látky μi v plynném stavu platí
![]()
kde μi°(T, p°) je molární Gibbsova energie
čisté složky (chemický potenciál čisté složky) ve stavu ideálního
plynu při teplotě T a tlaku p° a ![]() je
parciální molární objem i−té složky.
je
parciální molární objem i−té složky.
Fugacita a fugacitní koeficient i−té složky jsou definovány relacemi

Spojením těchto rovnic dostaneme pro fugacitu a fugacitní koeficient i−té složky vztahy
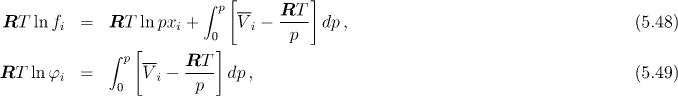
Aktivita i−té složky je definována vztahem
![]()
kde (μi)st.stav je chemický potenciál složky ve zvoleném standardním stavu.
Pokud se plynná směs chová podle Amagatova zákona dostaneme pro
fugacitní koeficient (![]() )
)
![]()
Toto vyjadřuje tzv. Lewisovo-Randallovo pravidlo. Podle tohoto pravidla fugacitní koeficient složky ve směsi je roven fugacitnímu koeficientu čisté složky při stejné teplotě a tlaku.
Pokud se plynná směs chová podle stavové rovnice ideálního plynu
platí (![]() )
)
![]()
Volíme-li standardní stav ideální plyn za teploty systému a standardního tlaku (nejčastější volba) platí
![]()
Pokud volíme standardní stav čistou složku ve stavu ideálního plynu za teploty a tlaku systému (méně obvyklá volba)
![]()
Při ideálním chování plynné fáze bude aktivita v prvém případě rovna pi/p° = pxi/p° a v druhém xi.