5.3 Parciální molární veličiny
Parciální molární veličiny jsou definovány vztahem

Parciální molární veličiny nejsou u dané směsi nezávislé veličiny, ale musejí splňovat tzv. Eulerův vztah
![]()
případně v diferenciálním tvaru Gibbsovu-Duhemovu rovnici (pro případ binárního systému)
![]()
Mezi parciálními molárními veličinami existují analogické relace jako mezi systémovými veličinami. Nejdůležitější z nich jsou

Při určování parciálních molárních veličin z experimentálních dat vycházíme často ze systémových veličin. Jako příklad může sloužit závislost objemu systému na molalitě rozpuštěné látky, tj. V = V(T, p, m2), potom platí
![]()
Parciální molární objem rozpouštědla v takovém případě určíme z Eulerova vztahu (5.25)
![]()
na základě dříve určeného objemu ![]() .
.
Nejčastěji při určování parciálních molárních veličin vycházíme z molárních veličin a potom platí

U ideální směsi platí jednoduché relace
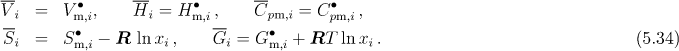
Parciální molární Gibbsova energie ![]() má pro svoji
důležitost speciální
název - chemický potenciál a speciální označení μi
má pro svoji
důležitost speciální
název - chemický potenciál a speciální označení μi
V případě, že vycházíme z dodatkových veličin platí např.
![]()
kde ![]() vyplývají z příslušné empirické či semiempirické
závislosti pro danou dodatkovou veličinu. Nejjednodušší relace pro binární systém
plyne ze vztahu (5.15)
vyplývají z příslušné empirické či semiempirické
závislosti pro danou dodatkovou veličinu. Nejjednodušší relace pro binární systém
plyne ze vztahu (5.15)
![]()
![]()
označuje jako parciální molární dodatková entalpie (≡ diferenciální
směšovací teplo
≡ diferenciální rozpouštěcí teplo ap.).
Tuto veličinu můžeme u binárního systému získat na základě vztahů
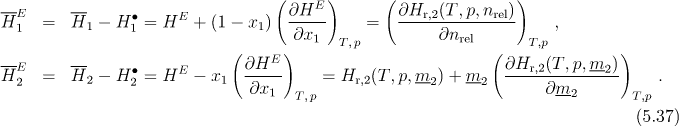
Příklady:
5.3.1 Stanovení parciálních molárních objemů ze závislosti objemu systému na molalitě (5.3.2 Určení parciálních molárních objemů ze závislosti molárního objemu na složení (
5.3.3 Rozpouštěcí teplo CaCl2 (
5.3.4 * Parciální molární objemy ze závislosti molárního objemu na složení (
5.3.5 Parciální molární objemy ze závislosti objemu na molalitě rozpuštěné látky (