8.6.2 Pyrolýza methanu
Pro pyrolýzu methanu byl navržen následující řetězový mechanismus
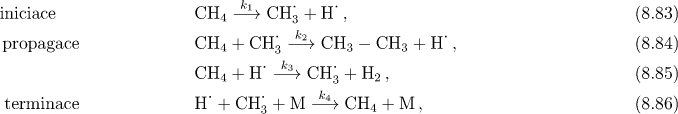
V poslední rovnici M představuje
molekulu, která odvádí část energie, která vzniká spojením
reaktivních radikálů H .
a
CH3 . . Na začátku reakce to může býti molekula
methanu, ke konci molekula ethanu. Za předpokladu, že koncentrace
radikálů CH3 . a H . je
velmi nízká a nezávislá na čase, odvoďte vztah pro úbytek
koncentrace methanu s časem vyjádřený pomocí koncentrací
měřitelných látek.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
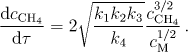
Postup
Z podmínky stacionárního stavu vyjádříme koncentrace reaktivních meziproduktů H . a CH3 . a ty dosadíme do diferenciální rovnice pro úbytek methanu.
Řešení
Pro úbytek koncentrace methanu s časem platí
![]()
Pro koncentrace radikálů CH3 . a H . platí
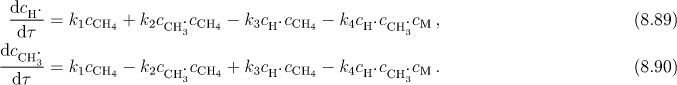
Ve stacionárním stavu předpokládáme platnost vztahů
![]()
Součtem anulovaných relací (8.89) a (8.90) získáme
![]()
Dosadíme-li tuto relaci do anulovaného tvaru rovnice (8.90) obdržíme po úpravě explicitní vztah pro koncentraci methylového radikálu
![]()
Zpětným dosazením do (8.92) obdržíme pro koncentraci H . .
![]()
Dosadíme-li poslední dvě relace do rovnice pro úbytek methanu s časem (8.88) dostaneme po úpravě
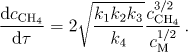
V počátečním stadiu reakce, kdy funkci molekul M přebírají molekuly methanu, získáme diferenciální rychlostní rovnici
![]()
která je vůči methanu I. řádu. V konečném stadiu (roli M přebírá vzniklý ethan) dostaneme relaci
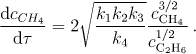
V tomto případě je reakce vůči methanu 1,5 řádu a ethan se projevuje jako inhibitor.